欢迎访问广州呼吸健康研究院!
奉献、开拓、实干、合群
2020-02-26 广州呼吸健康研究院 6516

分析血管紧张素转换酶II(ACE2)的表达水平,揭示新型冠状病毒2019-nCoV易感性和感染后免疫调节的潜在机制。
通过生物信息学方法分析6个独立研究(GSE37768, GSE73395, GSE89809, GSE63127, GSE97010, andGSE17400),覆盖健康人群,慢性阻塞性肺病患者,支气管哮喘患者和吸烟患者。运用GSEA分析ACE2相关生物学过程, 并通过ACE2单基因分析免疫细胞浸润。构建protein-protein interaction网络探究影响关键基因。
新型冠状病毒对正常人和慢性气道疾病人群易感性没有明显差异。吸烟人群ACE2表达明显上调,推测吸烟可能增强新型冠状病毒易感性。免疫细胞浸润分析,推测ACE2高表达有利于诱导细胞毒性反应、中性粒细胞炎症和Th2为主的免疫应答。同时,ACE2高表达与病毒复制和免疫反应密切相关(图1)。通过构建PPI网络,推测RPS3和SRC可能是ACE2介导的病毒复制和免疫反应中的关键基因(图2)。

图1 ACE2表达情况及GSEA分析
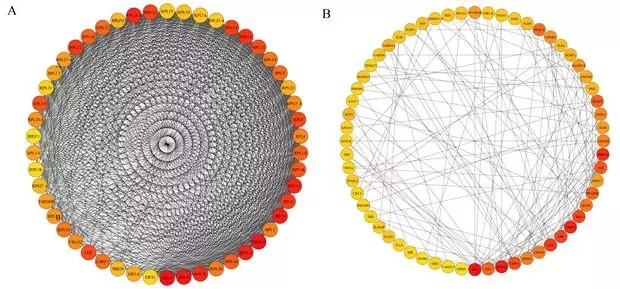
图2 PPI网络
我们利用生物信息学方法分析肺组织中ACE2的表达的情况,及其可能参与的相关生物学进程。这些发现可能有助于临床医生和研究人员2019-nCoV的发病机制和治疗策略有更多的了解。
武汉2019-nCoV感染是严重公共健康问题,由于病例数目仍在不断增加,感染范围不断扩大,人们对这次疫情的流行趋势密切关注。2019-nCoV通过呼吸道入侵肺部并引发肺炎是其致病最主要模式。生物信息学建模和体外实验均表明,2019-nCoV利用ACE2作为受体,从而感染细胞。实验室检查最初41例患者的数据表明,其淋巴细胞数目明显减少。临床研究也发现2019-nCoV感染重症患者后,其IL-1 B,IL-10和IL-8水平显著增高,表明2019-nCoV感染重症患者存在细胞因子介导的炎症反应。对2019-nCoV基因组的分析,这种新的病毒与SARS-CoV的序列同源性约为80~90%。有研究报道,SARS 患者常表现出过激的免疫反应,疾病严重程度与血清中炎性细胞因子水平相关,并且随着病情的加重,病毒载量却反而降低。这些现象表明宿主免疫反应在清除病毒感染的同时,也造成了宿主免疫病理损伤。由于同源性较高,我们推测免疫反应介导的病理损伤可能是2019-nCoV引起病人严重疾病的一个重要致病机制。在这篇研究中,ACE2高表达与固有免疫应答、获得性免疫应答、B细胞调节免疫和细胞因子分泌有关,能增强IL-1,IL-10,IL-6,IL-8细胞因子诱导的炎症反应。故我们推断免疫系统功能障碍与ACE2高表达有关,能导致“炎症因子风暴”的出现。同时,发现ACE2高表达增强病毒基因的复制,有利于病毒进入宿主细胞。这表明2019-nCoV感染上皮细胞后,通过调节ACE2,引起基因转录组学改变,促进病毒进入宿主细胞,同时能显著诱导T细胞激活、产生T细胞因子,介导显著的炎症反应。
据报道冠状病毒感染患者存在IL1B, IFNγ, IP10, and MCP1增高,推测与Th1细胞应答激活有关。这篇研究中发现, ACE2在肺组织中高表达诱导细胞毒性反应、中性粒细胞炎症和Th2为主的免疫应答。同时发现在SARS-CoV感染细胞后, ACE2的表达与病毒感染呈时间依赖性,AEC2主要介导中性粒细胞、NK细胞、Th17细胞、Th2细胞、Th1细胞、DC细胞、TNF-α分泌细胞等免疫应答细胞活化,这表明冠状病毒感染后,体内免疫应答被激活,从而诱导大量的炎症细胞参与免疫反应,爆发更明显的炎症反应。同时通过构建蛋白质互作网络,发现RPS3基因在病毒复制中起到关键作用,SRC非受体络蛋白激酶是炎症应答中的关键基因,根据这一发现,我们可以针对2019-nCoV的致病机制开展更多更深入的研究。
综上所述,这篇研究发现冠状病毒感染细胞后,ACE2的表达与病毒感染呈时间依赖性。ACE2高表达诱导中性粒细胞、NK细胞、Th17细胞、Th2细胞、Th1细胞、DC细胞、TNF-α分泌细胞等免疫细胞的激活,并促进免疫细胞参与介导产生更显著的炎症反应。ACE2高表达影响了RPS3和SRC这两个关键基因,利于病毒进入宿主细胞,促进免疫反应和炎症的爆发(图3)。这项研究的发现可以解释到目前为止的临床症状,一定程度上帮助临床医生和研究人员了解2019-nCoV的感染机制和设计治疗策略。
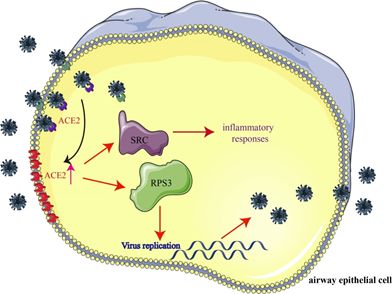
图3 2019-nCoV感染示意模型